

2017年5月5日,欧盟正式发布了新版MDR法规(MEDICAL DEVICE REGULATION EU 2017/745)/,并于2017/5/25正式生效,新的医疗器械和体外诊断试剂法规引入了医疗器械使用UDI的概念以及在欧洲医疗器械数据库(EUDAMED)注册以及上传文件的要求。只有带有UDI的医疗器械产品才可合法进入欧盟市场并自由流通。
(1)Basic UDI-DI是什么?怎么申请Basic UDI-DI?
欧盟的Basic UDI-DI是欧盟医疗器械法规中的一个概念,是器械类型的主要识别符,该代码与UDI-DI不同。UDI-DI跟着产品走,体现在产品、包装和标签上,实现的是产品追溯目的;而Basic UDI-DI跟着文件走,体现在证书、符合性声明和技术文件中,实现的是文件对应的产品组的识别。Basic UDI-DI的要求已经于2021年5月26日开始生效,广大制造商需要尽快申请编码并纳入自身的MDR文件体系。
(2)Basic UDI-DI和UDI-DI的差别
Basic UDI-DI是在医疗器械的一个器械组层面上分配DI并完成赋码,这个和原来UDI-DI需要针对每一组别产品中的每个规格,每个包装规格分别赋码是不同的。如5毫升和10毫升的注射器,分别按照100支装箱;那么UDI-DI就会有4个DI号码—5ml单支、10ml单支、5ml整箱、10ml整箱,而此时对应的Basic UDI-DI只有一个统一编码。
(3)Basic UDI-DI的用处
Basic UDI-DI是EUDAMED数据库中关键信息,同时会体现在CE证书、欧盟符合性声明和技术文件中,但不会出现在产品上
(4)Basic UDI-DI结构
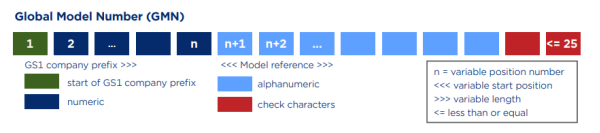
Basic UDI-DI是由Company Prefix + Model Reference+校验码组成,长度不能超过25位。其中,Company Prefix即厂商识别代码,与UDI中的一致。Model Reference,也就是产品识别代码,是由企业自行编制的,可以是字母+数字的形式。
(5)发码机构:
• GS1:Globe standard 1
• HIBCC :Health Industry Business Communicatios Council
• ICCBBA:International Council for Commonality in Blood Banking Automation
• IFA:Informationsstelle fur Arzneispezialitaten
(6)实施时间:
欧盟 类别 分类 UDI标识 合规日期 器械 植入类和Ⅲ类器械 包装、标签 2021年5月26日 器械本身 2023年5月26日 Ⅱa类和Ⅱb类器械 包装、标签 2023年5月26日 器械本身 2025年5月26日 Ⅰ类器械 包装、标签 2025年5月26日 器械本身 2027年5月26日 IVD D类IVD 包装、标签 2023年5月26日 B类和C类IVD 包装、标签 2025年5月26日 A类IVD 包装、标签 2027年5月26日


通用法规:
MEDICAL DEVICE REGULATION EU 2017/745
相关指南文件:
UDIWG 2018-1: UDI Database, Definitions/Descriptions and formats of the UDI core elements
MDCG-2018-2: Future EU medical device nomenclature - Description of requirements
MDCG-2018-3: Guidance on UDI for systems and procedure packs
MDCG-2018-4: Definitions/descriptions and formats of the UDI core elements for systems or procedure packs
MDCG-2018-5: UDI assignment to medical device software
MDCG-2018-6: Clarifications of UDI related responsibilities in relation to article 16
MDCG-2018-7: Provisional considerations regarding language issues associated with the UDI database
MDCG-2019-1: MDCG guiding principles for issuing entities rules on basic UDI-DI
MDCG-2019-2: Guidance on application of UDI rules to device-part of products referred to in article 1(8), 1(9) and 1(10) of Regulation 745/2017
MDCG-2018-1V4: Guidance on basic UDI-DI and changes to UDI-DI
MDCG-2019-4: Timelines for registration of device data elements in EUDAMED
MDCG-2019-5: Registration of legacy devices in EUDAMED
Commission Implementing Decision (EU) 2019/939: Designating issuing entities designated to operate a system for the assignment of Unique Device Identifiers (UDIs) in the field of medical devices
MDCG 2020-18:MDCG Position Paper on UDI assignment for Spectacle lenses & Ready readers
MDCG 2021-09:MDCG Position Paper on the Implementation of UDI requirements for contact lenses, spectacle frames, spectacle lenses & ready readers
MDCG 2021-19:Guidance note integration of the UDI within an organisation’s quality management system
实施时间
项目内容 官方时间(天) Eudamed账户申请 1 SRN注册申请 视实际情况而定 UDI申报与备案 视实际情况而定
官方费用 项目内容 费用 Eudamed账户申请 0 SRN注册申请 0 UDI申报与备案 0