

2013年9月美国食品药品管理局(Food and Drug Administration, FDA)发布医疗器械唯一标识系统(unique device identification system, UDI system)法规正式启动UDI实施工作
(1)UDI定义
UDI(Unique Device Identifier)基于标准创建的一系列由数字、字母数字符号组成的代码,包括产品标识和生产标识,用于对医疗器械进行唯一性识别。
(2)UDI构成
UDI=DI+PI
● DI=Device Identifier
产品标识
是特定于某种规格型号医疗器械的唯一性代码,可用作对医疗器械唯一标识数据库存储信息的“访问关键字”。
● PI=Production Identifier
生产标识
识别医疗器械生产过程相关数据的代码,根据实际应用需求可包含医疗器械序列号、生产批号、生产日期、失效日期等。
(3)发码机构
GS1:Globe standard 1
HIBCC:Health Industry Business Communicatios Council
ICCBBA:International Council for Commonality in Blood Banking Automation


21 CFR part 830 唯一医疗器械标识;
21 CFR part 801 标识;
21 CFR part 803 医疗器械报告;
21 CFR part 806 医疗器械,纠正与移除的报告;
21 CFR part 810 医疗器械召回;
21 CFR part 814 入市前许可;
21 CFR part 820 质量体系法规;
21 CFR part 821 医疗器械追踪的要求;
21 CFR part 822 上市后的监管。
实施时间
美国 | 设备类别 | 合规日期 | |
Ⅰ类和未分类医疗器械 | 无菌 | 2022年9月24日 | |
植入、生命支持、和生命维持 (I/LS/LS) 设备以外的Ⅱ类医疗器械 | 非无菌 | 2018年9月24日 | |
无菌 | 2016年9月24日 | ||
生命支持、和生命维持 (LS/LS) 医疗器械 | 非无菌 | 2015年9月24日 | |
无菌 | 2015年9月24日 | ||
Ⅲ类医疗器械 | 非无菌 | 2016年9月24日 | |
无菌 | 2014年9月24日 | ||
所有类别的、委托和外借的设备 | 非无菌或无菌 | 2014年9月24日:III 类 2015年9月24日:LS/LS 2016年9月24日:II 类 2018年9月24日:I 类 | |
官方费用
项目内容 | 费用 |
GUDID账户申请 | 0 |
UDI信息备案 | 0 |
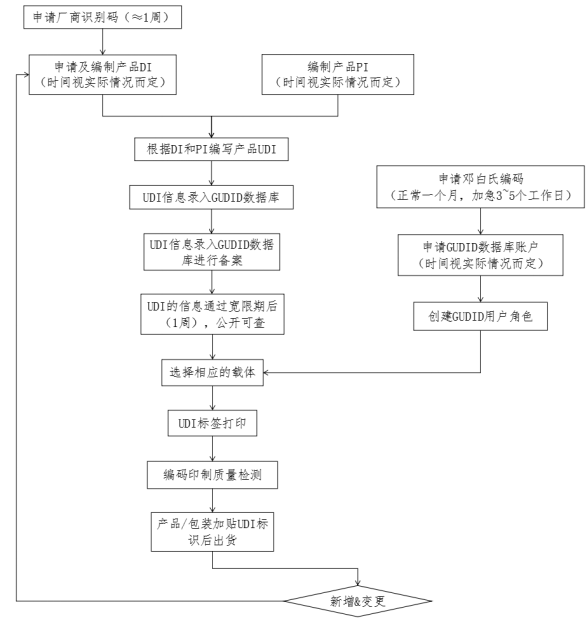
官方时间
项目内容 | 时间 |
GUDID账户申请 | 视实际情况而定 |
UDI信息备案 | 7天宽限期 |